![鋼管 [Pipes and Tubes]](/product/pipe/images_v3/pipesandtubes_pc.png)
ニュース
- 2025/04/18 米国のエネルギー向け展示会OTC2025に出展
- 2025/03/10 日本製鉄が化学工業・ボイラ用鋼管で環境ラベルプログラム「SuMPO EPD」認証を取得
- 2025/02/18 水素社会実現のための専門展 H2 & FC EXPO【春】2025に出展 ~ 高圧水素用HRX-19と液化水素用HYDLIQUIDを紹介 ~
- 2025/01/30 シンガポール最大級の鋼管問屋 HUPSTEEL社での日本製鉄のグリーンスチール「NSCarbolex Neutral」採用について
- 2024/10/30 中東のエネルギー関連展示会ADIPEC・ジャパンパビリオンに出展
- 2024/10/18 高機能素材Week東京展「第4回サステナブルマテリアル展」に出展
- 2024/10/07 日本製鉄が熱押形鋼で環境ラベルプログラム「SuMPO EPD(旧エコリーフ)」認証を取得
- 2024/07/10 AkerBP と油井管の長期供給契約を更新 ~油井管の安定供給を通して戦略的パートナーシップを強化~
- 2024/07/03 エクイノールと油井管の長期供給契約を更新 ~油井管の安定供給を通して戦略的パートナーシップを強化~
- 2024/06/14 カタール国/ブルーアンモニア製造プラント建設プロジェクトに使用されるCCS向けで高合金シームレス油井管受注とグリーンスチール「NSCarbolex Neutral」の採用が決定
- 2024/04/23 米国のエネルギー向け展示会OTCに出展
- 2024/04/11 2024 AMPP Fellow Honor Awardの受賞について ~世界130の国と地域の54,000名以上が加入する米国「材料腐食防食協会」より受賞~
- 2024/02/27 H2 & FC EXPO水素燃料電池展【春】2024に出展高圧水素用HRX-19と液化水素用HYDLIQUIDを紹介
- 2023/09/28 85 Degrees RenewablesおよびITECO社のオランダ地熱開発井に日本製鉄が提供する低CO2鋼材「NSCarbolex Neutral」の採用が決定
- 2023/09/27 「第10回高機能金属展」に出展
- 2022/03/11 第18回国際水素・燃料電池展FC EXPO【春】に出展
- 2020/04/28 シェルよりサプライヤーアワードを受賞
- 2019/02/19
日本製鋼所と高圧昭和ボンベ、新日鉄住金の3社、水素ステーション用の
鋼製蓄圧器の新型を共同開発し、商業生産開始 - 2018/11/27 幕張メッセで開催される「第5回高機能金属展」に出展
- 2018/11/27
薄肉化した高強度鋼管を用いた新AGF工法を開発
~ 不安定な岩盤におけるトンネル掘削作業の負荷を軽減し、生産性を向上 ~
- 2018/11/12 中東のエネルギー向け展示会ADIPECに出展
- 2018/07/30 BPオマーンとの戦略的パートナーシップ継続について
- 2018/07/26 環境配慮型油井管用ねじ継手「CLEANWELL®DRY」の新製品発売 環境規制の最も厳しい北海地域での使用開始
4.内面腐食 - 淡水腐食
内面腐食については、メカニズム的には外面腐食と同様ですが、環境が土壌から電解質溶液(水)に変わったものと考えればよいでしょう。
a. pHの影響
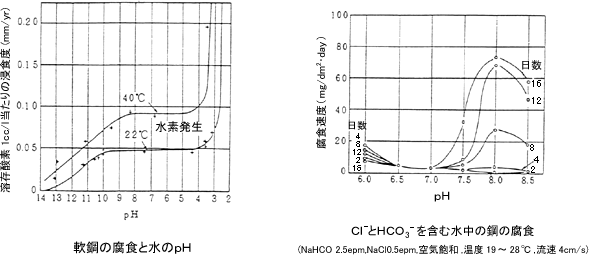
次図に示すように、pH4~9の範囲では、鉄面が水酸化物皮膜でおおわれ、腐食は水のpHと関係なく、皮膜を通過する酸素による復極で決定されますが、pH4以下では皮膜が溶け去り水素発生形の激しい腐食となります。皮膜に有害な塩化物などを溶存する領域では、次図と多少変わってきますが、Cl-とHCO3-を含有する水ではpH8付近で腐食が増し錆コブ発生傾向が現れます。
b. 溶存酸素の影響
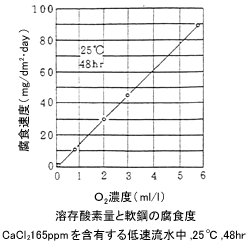
淡水中の腐食は、pHの極端に低い場合を除き、腐食速度は溶存酸素量に比例します。
多くの金属表面で、溶存酸素濃度に不均一があると通気差電池のため低酸素の接面が陽極となって局部的に腐食します。錆コブの下部や隙間部分などにこの種の局部腐食は発生しやすいのです。(図2)
c. 溶解塩分の影響
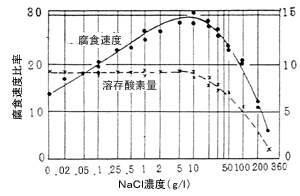
水中に塩分などの溶解成分が増加しますと水の電導度が上昇し、その結果局部電流が増すとともに、腐食生成物が金属面から離れたところに沈殿するので腐食速度が増大します。しかし腐食が多くの塩類で約0.5Nで最大となり、それより高濃度で腐食が漸減するのは溶存酸素が減るためです。
溶解塩分としては、陽イオンよりも陰イオンの影響が大きく、中でもCl-などハロゲンイオンは一般の腐食のほか孔食,応力腐食の原因となるので有害ですが、SO42-やNO3-はCl-に比べると影響度は小さいでしょう。
d. 炭酸の影響(炭酸カルシウム飽和指数)
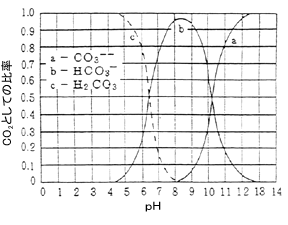
水中に溶存する遊離の炭酸は腐食性ですが、溶存酸素に比べると軽微です。むしろ、炭酸カルシウムを多く含む水では、陰極部にCaCO3の皮膜を形成しますので防食効果があります。従って、硬水は軟水よりも腐食しにくいのです。
次図に示すとおり、pH8以下の水は、遊離炭酸を含有しますが、pH8以上では結合炭酸のみとなります。
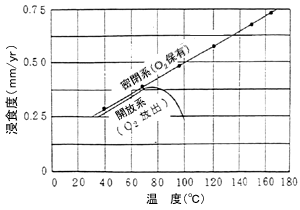
e. 温度の影響
水温10℃の上昇毎に、腐食速度は30%増加します。配管が開放系(流体と大気とが接する)の場合、80℃付近で極大となります。これは、溶存酸素を放出するためです。
お問い合わせ
製品に関するお問い合わせ
会社団体名、お問い合わせ内容等の記載に漏れや不備がある場合や、お見積りに関するご質問等については、回答できない場合もございますので、予めご了承ください。
